2019年全球淋巴癌發病率調查結果顯示,我國淋巴瘤發病率約為(wèi)6.3/10萬人(rén),每年新(xīn)發病例約為(wèi)9萬人(rén) ,已成為(wèi)我國男性的第八大高發惡性腫瘤(占比約2.1%)。雖然目前已上(shàng)市(shì)CD19-CAR-T(如(rú)Kymriah,yescarta)細胞療法對B細胞淋巴瘤有較好(hǎo)(hǎo)的療效,但(dàn)是需要自體(tǐ)采血,制備周期長、價格昂貴,普通人(rén)難以負擔;市(shì)面上(shàng)還有CD3/CD19雙特異性抗體(tǐ)治療可供選擇,但(dàn)是其全身(shēn)性給藥易産生(shēng)細胞因子(zǐ)風(fēng)暴等嚴重的毒副作(zuò)用。因此,迫切地需要新(xīn)的治療方法。
溶瘤病毒是一(yī)類能(néng)夠選擇性地感染、複制和破壞腫瘤細胞的腫瘤殺傷型病毒,此類産品的生(shēng)産工藝成熟,可以大批量制備“現(xiàn)貨”型治療藥物,大大降低(dī)制作(zuò)的時(shí)間(jiān)和費用成本。2015年,Talimogene laherparepvec(T-VEC)成為(wèi)首個(gè)被FDA批準的溶瘤病毒,用于惡性黑色素瘤的治療,而後聯合PD-1抗體(tǐ)治療,療效倍增。這(zhè)是由于溶瘤病毒可誘導全身(shēn)性抗腫瘤免疫反應,起到更好(hǎo)(hǎo)的抗腫瘤作(zuò)用。
近日,榮谷生(shēng)物研發團隊攜手浙大二院、浙江省人(rén)民(mín)醫(yī)院的專家團隊在Nature子(zǐ)刊《Blood Cancer Journal》發表了(le)研究成果“CD19-targeted BiTE expression by anoncolytic vaccinia virus significantly augments therapeutic efficacy againstB-cell lymphoma”。該團隊研發了(le)一(yī)種能(néng)編碼 CD19 特異性BiTE的溶瘤痘苗病毒(OVV-CD19BiTE),将免疫治療和溶瘤病毒治療整合一(yī)體(tǐ)化(huà),并證明其有更高效的抗腫瘤作(zuò)用。

在本研究中,研究團隊首先在體(tǐ)外證明了(le),OVV-CD19BITE能(néng)夠促進T 細胞的活化(huà)和增殖,上(shàng)調了(le)CD4+和CD8+T細胞上(shàng)的活化(huà)标志物CD25、OX40和4-1BB,顯著誘導與T細胞耗竭相關(guān)的PD-1表達。此外,OVV-CD19BITE能(néng)夠誘導T細胞介導的旁觀者效應。
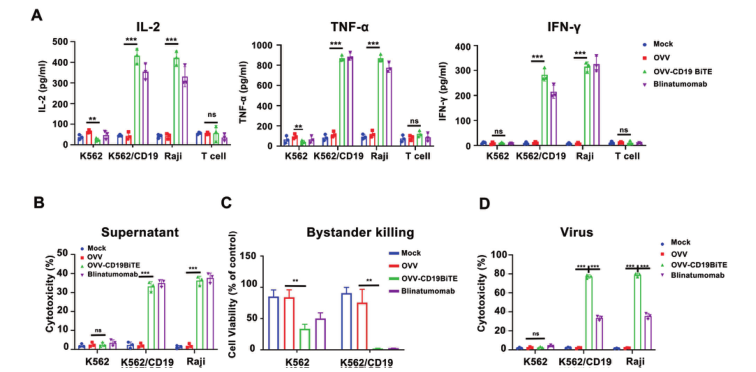
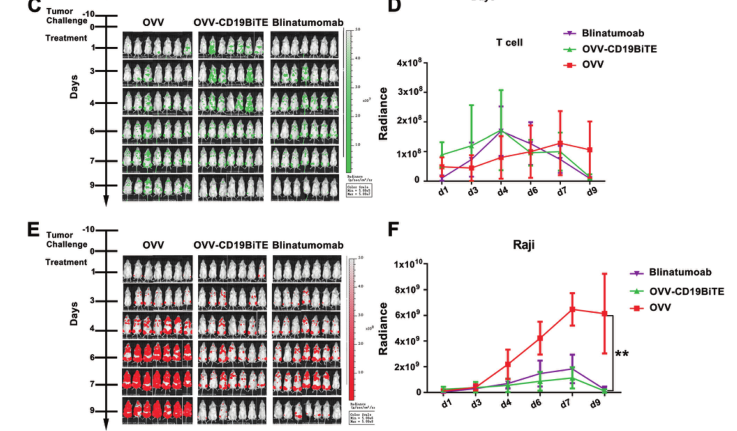
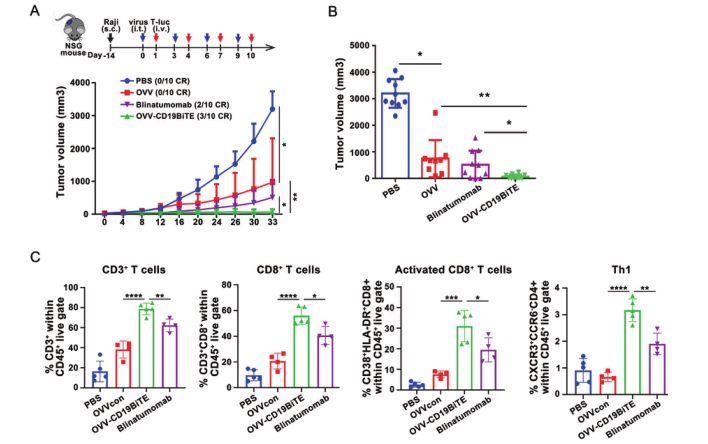
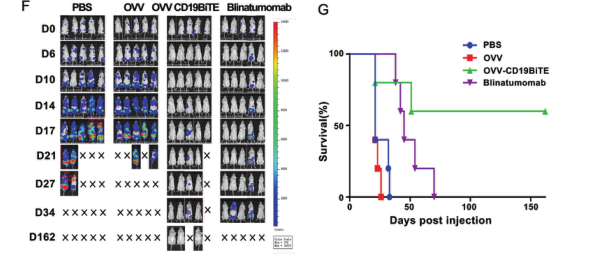
之後,研究團隊在體(tǐ)外進一(yī)步驗證了(le)OVV-CD19BITE的抗腫瘤作(zuò)用。在NSG小鼠中,通過小動物活體(tǐ)成像體(tǐ)系可以看到,OVV-CD19BITE可以招募更多的T細胞到腫瘤部位,并延長T細胞的生(shēng)存時(shí)間(jiān),起到更好(hǎo)(hǎo)的抗腫瘤作(zuò)用。而通過瘤内治療OVV-CD19BITE可以抑制腫瘤的生(shēng)長,延長小鼠的生(shēng)存期,并且可有效刺激腫瘤微環境内CD3+T細胞、CD8+T細胞、活化(huà)CD8+T細胞和Th1細胞的比例,改善了(le)腫瘤微環境,将“冷”腫瘤轉變為(wèi)“熱”腫瘤;之後,為(wèi)了(le)進一(yī)步模拟臨床上(shàng)的淋巴瘤,通過NSG小鼠全身(shēn)成瘤,腹腔治療的方法,進一(yī)步進行驗證。結果顯示,OVV-CD19BITE可以抑制腫瘤的生(shēng)長,延長小鼠的生(shēng)存期。并且,通過小動物活體(tǐ)成像體(tǐ)系可以看到,OVV-CD19BITE組有3隻小鼠的腫瘤完全消退,得到了(le)長期的生(shēng)存。
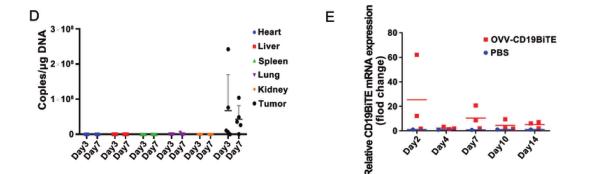
最後,研究團隊進一(yī)步驗證了(le)OVV-CD19BITE的安全性。通過qPCR的方法,隻有在腫瘤中可以檢測病毒的存在,而在其他組織中沒有檢測到病毒的殘留。說(shuō)明該重組病毒的安全性是比較好(hǎo)(hǎo)的,為(wèi)進一(yī)步的臨床試驗做好(hǎo)(hǎo)了(le)準備。