嵌合抗原受體(tǐ)T(CAR-T)細胞治療是一(yī)種有潛力的過繼細胞治療策略的個(gè)體(tǐ)化(huà)癌症免疫治療領域。
CAR-T細胞治療在B細胞惡性血液病的治療中引發了(le)一(yī)場(chǎng)革命,并在其他難治性惡性血液病患者中産生(shēng)了(le)顯著的臨床療效。目前,已經有五種FDA批準的靶向CD19或BCMA分(fēn)子(zǐ)的CAR-T細胞療法,用于治療複發的難治性B細胞急性淋巴細胞白血病、大B細胞非霍奇金(jīn)淋巴瘤、複發的難治性套細胞淋巴瘤和複發的難治性多發性骨髓瘤。
然而,由于腫瘤的異質性和腫瘤微環境(tumor microenvironment, TME)的複雜性,其治療實體(tǐ)瘤的療效尚未得到證實。TME通常含有許多免疫抑制細胞,如(rú)調節性T細胞(Treg)、髓系幹細胞(MDSC)、腫瘤相關(guān)巨噬細胞(TAMs),以及腫瘤組織中的免疫抑制分(fēn)子(zǐ),缺乏抗腫瘤免疫細胞的浸潤。所有這(zhè)些(xiē)都明顯削弱了(le)CAR-T細胞治療實體(tǐ)腫瘤的抗腫瘤作(zuò)用。而近年來(lái)研究者發現(xiàn)了(le)腫瘤細胞免疫逃逸機制中的關(guān)鍵蛋白—CD47的高表達能(néng)夠抑制巨噬細胞和樹突狀細胞對腫瘤細胞的識别和吞噬作(zuò)用。二者聯系在一(yī)起,中山大學醫(yī)學院黃(huáng)朝峰博士及其團隊在今年2月(yuè)(yuè)以“Delivery of CD47 blocker SIRPα-Fc by CAR-T cells enhances antitumor efficacy”為(wèi)題發表于“ImmunoTherapy of Cancer”雜志中。

該團隊開發了(le)分(fēn)泌CD47阻滞劑Sirf CAR-T細胞,SIRPα-Fc蛋白,以研究其是否能(néng)增強巨噬細胞的吞噬能(néng)力和CAR-T細胞在實體(tǐ)腫瘤中的治療效果。這(zhè)項研究揭示了(le)SIRPα-Fc蛋白與CAR-T細胞聯合用于實體(tǐ)腫瘤治療的潛力。
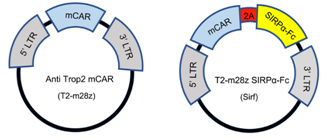
首先,由于Trop2可以作(zuò)為(wèi)CAR-T細胞的靶點,在研究團隊之前的文章(“CD27 enhances the killing effect of CAR T cells targeting trophoblast cell surface antigen 2 in the treatment of solid tumors”)中證明過小鼠T2-CAR-T細胞的抗腫瘤作(zuò)用。因此這(zhè)裏選用小鼠T細胞轉導來(lái)表達傳統的抗Trop2 CAR和Sirf CAR(即T2-m28z與Sirf如(rú)圖A),以及選用未轉導的T細胞來(lái)作(zuò)為(wèi)陰性對照。
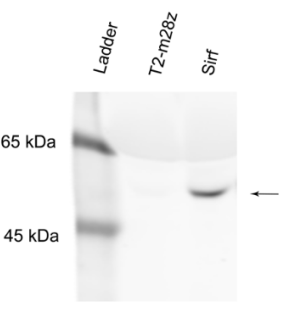
通過對CAR-T細胞培養上(shàng)清進行anti-His免疫印迹,進一(yī)步證實了(le)CAR-T細胞分(fēn)泌SIRPα-Fc,目的蛋白存在于Sirf CAR-T細胞上(shàng)清中,而T2-m28z中不存在(圖B)。
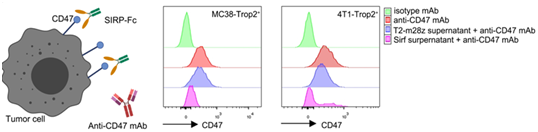
研究團隊使用了(le)基于流式細胞術的抗體(tǐ)競争實驗。在MC38-Trop2和4T1-Trop2腫瘤細胞上(shàng)發現(xiàn)CD47在基線水平高表達。而與Sirf CAR-T細胞上(shàng)清共孵育後,CD47染色的熒光強度顯著降低(dī),但(dàn)與T2-m28z CAR-T細胞共孵育後沒有下(xià)降(圖C)。結果表明Sirf CAR-T細胞分(fēn)泌的SIRPα-Fc蛋白可以與腫瘤細胞上(shàng)的CD47分(fēn)子(zǐ)結合。
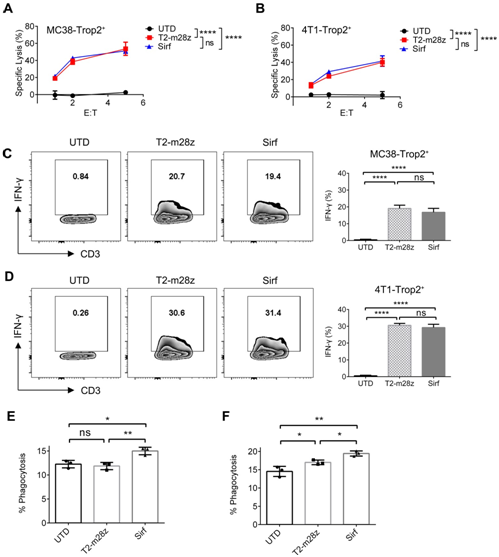
接下(xià)來(lái),為(wèi)了(le)确定SIRPα-Fc是否影響CAR- T細胞的殺傷能(néng)力,研究團隊執行LDH釋放(fàng)試驗,結果表明Sirf和T2-m28z CAR-T細胞都對MC38-Trop2+細胞和4T1-Trop2+細胞表現(xiàn)出相似的腫瘤溶解能(néng)力(圖1A,B)以及IFN-γ的表達(圖1C,D)。這(zhè)說(shuō)明分(fēn)泌SIRP α-Fc對體(tǐ)外CAR-T細胞的抗腫瘤作(zuò)用沒有不利影響。随後,團隊測試了(le)加入不同CAR-T細胞培養上(shàng)清後對腫瘤細胞的吞噬能(néng)力。結果顯示,Sirf CAR-T細胞上(shàng)清與傳統CAR-T細胞相比可以增強吞噬作(zuò)用(圖1E)。此外,CAR-T細胞經腫瘤抗原刺激後可誘導IFN-γ表達。研究團隊分(fēn)析了(le)不同CAR-T細胞與MC38-Trop2+細胞共培養後的上(shàng)清對巨噬細胞的吞噬作(zuò)用。發現(xiàn)Sirf CAR-T細胞上(shàng)清液比未轉導的T細胞或傳統CAR-T細胞上(shàng)清液有明顯的促進吞噬作(zuò)用(圖1F)。
總之,這(zhè)些(xiē)體(tǐ)外數據表明分(fēn)泌的SIRPα-Fc蛋白增強巨噬細胞的吞噬能(néng)力,但(dàn)不損害CAR-T細胞的活性。
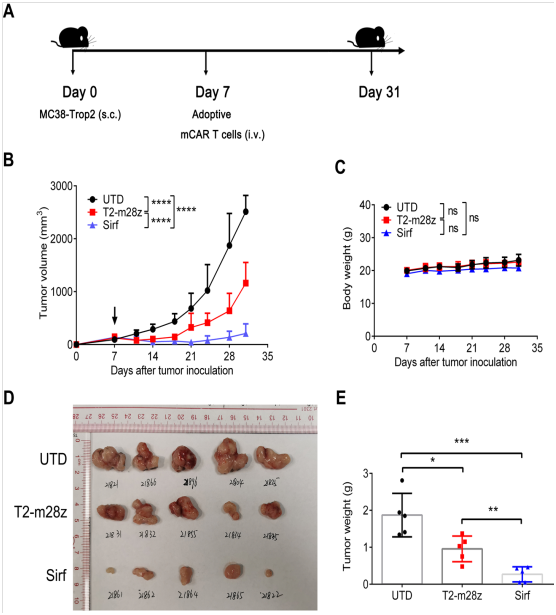
下(xià)一(yī)步是探究Sirf CAR-T細胞在免疫小鼠模型中的抗腫瘤活性。團隊用C57BL/6小鼠接種MC38-Trop2+ (s.c.),然後用Sirf CAR-T細胞、T2-m28z CAR-T細胞與未轉染基因的活化(huà)T細胞處理(lǐ)(圖2A)。與對照組相比,T2-m28z CAR-T和Sirf CAR-T細胞對腫瘤生(shēng)長都有中度的抑制作(zuò)用(圖2B)。Sirf CAR-T細胞治療的小鼠與T2-m28z CAR-T細胞治療的小鼠相比,可以觀察到對腫瘤生(shēng)長的附加控制。從體(tǐ)重變化(huà)可以看出,治療與潛在毒性無關(guān)(圖2C)。在第31天切除腫瘤(圖2D) 進一(yī)步檢驗CAR-T細胞的抗腫瘤療效,Sirf CAR-T細胞治療組的腫瘤體(tǐ)積顯著減少(圖2E)。
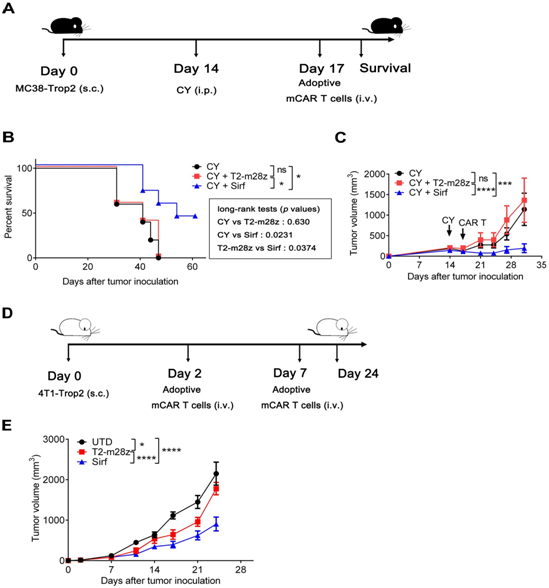
在許多臨床實踐中,CAR-T細胞治療通常需要低(dī)劑量的氟達拉濱或CY預處理(lǐ)。為(wèi)了(le)确定聯合治療效果,小鼠接種MC38-Trop2+ (s.c.),使用CY (i.p.)預處理(lǐ),然後靜脈注射CAR-T細胞(圖3A)。在這(zhè)個(gè)治療過程中,Sirf CAR-T細胞的使用顯著延長了(le)小鼠的生(shēng)存時(shí)間(jiān)(圖3B)和減少了(le)腫瘤負擔(圖3C)。此外,Sirf CAR-T細胞的強抗腫瘤治療效果在4T1-Trop2+模型中也(yě)得到了(le)進一(yī)步的證實(圖3D)。Sirf CAR-T細胞治療能(néng)顯著減少腫瘤體(tǐ)積,而T2-m28z CAR-T細胞治療效果有限(圖3E)。
這(zhè)些(xiē)結果表明Sirf CAR-T細胞可以提高對實體(tǐ)腫瘤的治療效果。
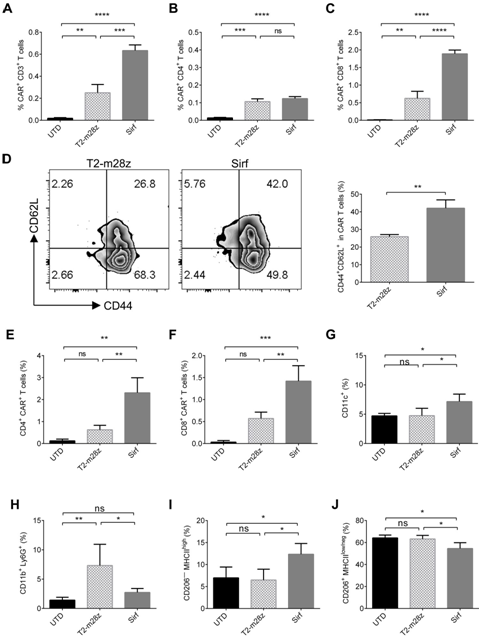
然後,研究團隊用流式細胞術分(fēn)析了(le)分(fēn)泌的SIRPα-Fc是如(rú)何調節荷瘤小鼠體(tǐ)内免疫細胞的,SirfCAR-T細胞處理(lǐ)的小鼠脾髒CD3+T細胞中CAR-T細胞的比例高于T2-m28z組,而在CD8+CAR-T細胞中則更為(wèi)顯著(圖4A-C)。此外,Sirf CAR-T細胞提高了(le)小鼠脾細胞中CD44+CD62L+中央記憶T細胞(TCM)的比例(圖4D)。果然,在Sirf CAR-T細胞治療的腫瘤組織中CAR-T細胞的比例顯著高于對照組(圖4E,F)。此外,在Sirf CAR-T細胞治療的腫瘤組織中,CD11c+DC的比例增加(圖4G),而髓系源性抑制細胞(MDSC)的比例下(xià)降(圖4H)。Sirf CAR-T細胞處理(lǐ)後,M1型巨噬細胞比例增加(圖4I),M2型巨噬細胞比例減少(圖5J),表明Sirf CAR-T細胞的治療可以增強巨噬細胞的抗腫瘤功能(néng)。即Sirf CAR-T細胞産生(shēng)的SIRPα-Fc不僅可以增強CAR-T細胞的持久性,而且可以影響TME。
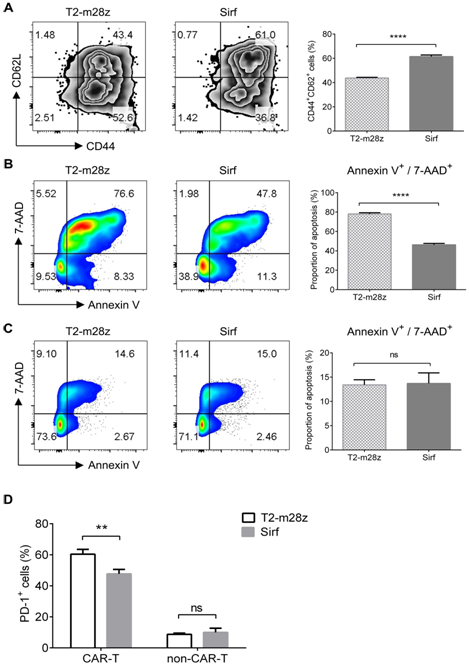
最後,團隊分(fēn)析了(le)不同CAR-T細胞在MC38-Trop2+腫瘤細胞抗原刺激後表面标記物的變化(huà)。與體(tǐ)内研究結果一(yī)緻,觀察到TCM在Sirf CAR-T細胞中的比例明顯高于T2-m28z CAR-T細胞(圖5A)。随後,檢測了(le)CAR+T細胞與腫瘤細胞共培養後的凋亡。在腫瘤抗原刺激後,Sirf CAR-T細胞中凋亡細胞比T2-m28z CAR-T細胞中凋亡細胞少(圖5B),但(dàn)不能(néng)被腫瘤抗原刺激的非CAR-T細胞中凋亡細胞沒有差異(圖5C)。此外,還發現(xiàn)程序性細胞死亡1 (PD-1)在Sirf CAR-T細胞上(shàng)的表達低(dī)于T2-m28z CAR-T細胞(圖5D)。表明PD-1通路(lù)參與調控Sirf CAR-T細胞的抗腫瘤作(zuò)用。
在這(zhè)項研究中,該團隊開發了(le)Sirf CAR-T細胞,可以産生(shēng)CD47阻斷劑,SIRPα-Fc融合蛋白。從實驗結果來(lái)看Sirf CAR-T細胞在體(tǐ)内顯示了(le)強大的抗腫瘤活性和提高了(le)對實體(tǐ)腫瘤的治療效果。結果顯示,CAR-T細胞分(fēn)泌的SIRPα-Fc增強了(le)巨噬細胞的吞噬能(néng)力,改進了(le)CAR-T細胞的持續凋亡,并減少了(le)腫瘤組織中的免疫抑制。這(zhè)些(xiē)體(tǐ)現(xiàn)Sirf CAR-T細胞在實體(tǐ)腫瘤治療中的潛力。
文章來(lái)源: https://pubmed.ncbi.nlm.nih.gov/35110357/
